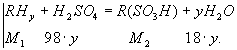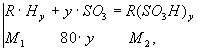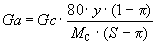3.2. Химизм процесса сульфирования
Подготовленный сульфоагент или техническая кислота для реализации процесса сульфирования смешивается в аппарате с соответствующим углеводородом. Реакция сульфирования при этом может быть представлена в следующем виде:
|
|
(3.3) |
В случае использования олеума в качестве сульфоагента процесс идет по следующей реакции:
|
|
(3.4) |
где
RHу - углеводород; у - число атомов водорода, замещаемых сульфогруппами; R(SO3H)у - сульфопродукт (сульфокислота); M - молекулярный вес.Весовое соотношение веществ, участвующих в процессе сульфирования только в идеальном случае может приближаться к стехиометрическому соотношению по уравнениям (3.3) и (3.4). На практике, в силу специфики процесса сульфирования, расход сульфирующего агента значительно больше, чем его количество, рассчитанное по уравнениям (3.3) и (3.4).
Специфика процесса заключается в следующем. Для данного органического соединения сульфирующий агент должен иметь концентрацию
SO3, превышающую некоторое критическое значение. Сульфирующий агент меньшей концентрации, как бы не было велико его относительное количество, практически не может сульфировать данное органическое соединение. Эта критическая, концентрация обозначается через p (p -сульфирования) и выражается через сотые доли серного ангидрида, содержащегося в сульфирующем агенте. Для каждого органического вещества эта величина определяется экспериментально. Зная величину p и концентрацию серного ангидрида в сульфирующем агенте S (S-сульфирования) можно с помощью уравнения (3.4) установить количественные соотношения реагентов:|
|
(3.5) |
где
Ga - расход сульфирующего агента; Gс - вес исходного органического соединения.Анализ уравнения (3.5) показывает, что расход сульфоагента значительно превышает теоретический, рассчитанный по уравнениям (3.3) и (3.4). Этот перерасход тем больше, чем меньше концентрация серного ангидрида в исходном сульфоагенте.
Перерасход сульфирующего агента всегда имеет место, так как часть агента расходуется на побочные реакции (образование полисульфокислот). Значительный перерасход агента приводит к непроизводительным затратам энергии и сырья (как самого сульфоагента и продуктов на обработку сульфомассы после реакции: мела, соды, извести). Пути снижения расходов сырья показывает анализ уравнения (3.5). Так расход сульфирующего агента, а следовательно, и других продуктов можно уменьшить путем увеличения концентрации серного ангидрида (S - сульфирования). Это достигается удалением воды из реакционной массы во время процесса сульфирования (отгонка с парами сульфируемого продукта, добавка веществ, связывающих воду).
В заключении следует отметить, что сульфирование проводится в широком диапазоне температур (в зависимости от органического вещества): от -10 °С до 180 °С и, как правило, под атмосферным давлением. Диапазон температур сульфирования показывает, что для реализации процесса используются различные хладоагенты: вода, холодильные рассолы, а также различные теплоносители: пар различного давления и высокотемпературные органические теплоносители (ВОТ).
Подвод или отвод тепла в процессе сульфирования и смешения кислот (подготовка сульфоагента) определяют во многом конструкции аппаратов для проведения реакции. Очевидно, что аппарат должен иметь теплопередающее устройство: змеевик или рубашку, а перемешивание реакционной смеси в нем должно осуществляться мешалкой или с помощью барботера.
|
|
|
|