


“Технология
производств отрасли ”
1. Процесс идет непрерывно. Непрерывный поток нефтяных паров, предварительно нагретый до необходимой для реакции температуры, и непрерывный поток воздуха поступают как смесь в реакционную зону. Эта смесь составляется в строго определенных количествах воздуха нефтяных паров. Поступающий в реакционную зону продукт задерживается в течение необходимого для окончания реакции промежутка времени, подвергается действию высоких температур и выводится непрерывным потоком из реакционной зоны. Далее смесь охлаждается, конденсируется и выводится как окончательные продукты.
2. Процесс происходит при постоянной реакционной температуре. Температурный фактор является важнейшим фактором крекинг – процесса, поэтому возможность проведения реакции при строго постоянных температурах должна являться решающим моментом. Действие постоянной реакционной температуры при окислительном крекинге происходит с исключительной быстротой, почти мгновенно, так что фактически во всех точках реакционного пространства устанавливается одна и та же постоянная температура.
3. Процесс происходит в исключительно паровой фазе. Здесь главная особенность процесса заключается в том, что необходимое для реакции количество теплоты сообщается не путем наружного нагревания нефтяных паров через стенки металлических труб, а непосредственно путем внутреннего нагревания, путем одновременного введения необходимого для создания реакционной температуры количества воздуха в реакционное пространство. С введением воздуха одновременно происходят два процесса:
а) выделение реакционной теплоты при самом процессе окисления и
б) усиленное испарение разбавленных нефтяных паров благодаря присутствию нейтральных газов – азота воздуха и продуктов горения.
4. Самой характерной особенностью окислительного крекинга являются, те реакции, которые непосредственно связаны одним новым фактором – введением кислорода воздуха в реакционное пространство. В результате этого создается совершенно новый, еще неизученный термический процесс. Характерным признаком неполного сгорания служит красное, сильно коптящее пламя, а также преимущественное образование в результате реакции СО вместо СО2, при окислительном крекинге отсутствует. Среди продуктов окисления образуются, главным образом, углекислота и вода, но могут, в зависимости от глубины процесса, образовываться и кислородсодержащие органические соединения, хотя, по желанию, мы можем установить и такой режим, что они могут и не получаться.
a) Метан, как простейший углеводород, состоящий из единственной элементарной тетраэдрической системы.
b) Ацетилен, как простейший, ненасыщенный углеводород.
c) Бензол, как самый прочный высокомолекулярный углеводород.
Эти три самые устойчивые углеводороды сохраняют свою термическую устойчивость до 1000 градусов Цельсия. При этом распад метана на элементы хотя и начинается при 1000 С и быстро прогрессирует выше 1000 С, но полный его распад происходит только при 1250 С. При окислительном крекинге одновременно с процессами термического распада происходит и действие нового фактора – кислорода, глубоко влияющего на весь ход реакции. Под воздействием кислорода изменяются:a) Термическая устойчивость углеводородных молекул
b) Происходит реакции: отнятие водорода, отщепление воды, разрыв цепей и другие.
c) Кислород вступает в химическую связь с углеводородами – образуются кислородсодержащие органические соединения.
В основном процесс окисления углеводородов является химической реакцией, заключающейся или в присоединении к углеводороду кислорода, или в замене водорода кислородом, или же в отнятии от окисляющего тела водорода. В начальной стадии процесса окисления при низких температурах скорость окисления углеводородов чрезвычайна низка. Даже у углеводородов с большой теплотой сгорания реакция протекает очень медленно. Происходит это потому, что выделение реакций теплоты при процессе окисления компенсируется тепловыми потерями в окружающее пространство. Когда возрастающие температуры достигли уже определенного предела, при котором углеводороды теряют свою устойчивость, наступает воспламенение и скорость реакции сильно увеличивается: окисление переходит в горение. Благодаря присутствию обильного количества воздуха вся масса углеводородов при сильном экзотермическом процессе с быстротой переходит из области окисления в область горения и взрыва. Область окисления, горения и взрыва уже хорошо известны и основательно изучены, важнейшая же область окислительного крекинга не только не изучена, но даже неизвестна. При высоких температурах и в присутствии обильного кислорода мы не имеем возможности контролировать процесс горения. Нет возможности ни увеличивать, ни уменьшать скорость процесса, мы не можем повлиять ни на выделение реакционной теплоты, ни на температуру реакции, ни на глубину всего процесса. Чтобы практически осуществить термическую реакцию в области окислительного крекинга, для этого необходимо создать определенные условия: во-первых, необходимо создать в реакционном пространстве необходимую реакционную температуру, без этой температуры не может начаться реакция: во-вторых, необходимо сильно ограничить количество кислорода до такой степени, чтобы выделяемая во время процесса реакционная теплота была только достаточна на поддержание постоянной температуры в реакционной зоне. При окислительном крекинге одновременно происходят два сложных процесса: термический распад и окисление. Скорость реакции окислительного крекинга является, прежде всего, функцией температуры. Окислительный крекинг углеводородов является термохимической реакцией, которая состоит из непрерывной цепи аддитивных химических превращений при постоянной температуре и при постоянной скорости реакции. Таким образом, при реакции невозможны: стихийное выделение реакционной теплоты, воспламенение, переход в стадию горения и все возрастающая скорость реакции, которая заканчивалась бы мгновенной реакцией – взрывом.
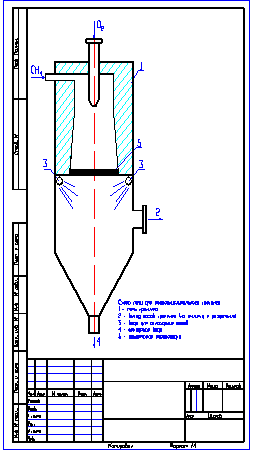
Схема печи выполнена в среде AutoCAD (файл в формате AutoCAD 2000)(.dwg) ).
При термоокислительном крекинге метана (см. рисунок) техническим кислородом получен крекинг – газ следующего состава:
| Наименование | % | Кмоль/100*нм3 |
| Водород Н2 | 54,2 | 2,4196 |
| Окись углерода СО | 26 | 1,1607 |
| Двуокись углерода СО2 | 4,2 | 0,1875 |
| Метан СН4 | 4,3 | 0,192 |
| Этилен С2Н4 | 0,3 | 0,0134 |
| Ацетилен С2Н2 | 8,2 | 0,3661 |
| Метил ацетилен СН3 – С = СН | 0,1 | 0,0045 |
| Диацетилен НС=С – С= СН | 0,1 | 0,0045 |
| Бензол (С6Н6) и другие высшие углеводороды | 0,1 | 0,0045 |
| Кислород О2 | 0,3 | 0,0134 |
| Азот N2 | 1,6 | 0,0714 |
| Аргон Ar | 0,6 | 0,0268 |
|
Итого |
100 | 4,4644 |
|
Кроме того, при крекинге получено сажи
4,2 г на 1 мн3 сухого газа. На
основании этих данных составить материальный и тепловой балансы печи
крекинга; подсчитать температуру, соотношение метана и кислорода,
поступающих на крекинг; определить расход воды на охлаждение крекинг
газа, если температура крекинга 1500 градусов Цельсия, крекинг -
газа на выходе из печи 650 градусов Цельсия, охлаждающей воды на
входе в печь 15 градусов Цельсия, а на выходе 75 градусов Цельсия,
теплопотери через стенки крекинговой печи 6%. Решение. Расчет ведем на 100 нм3 сухого газа крекинга. A. Материальный
баланс. 1.
На
образование 2,4196 кмоль
Н2 израсходовано |
 |
|
Состав сухого
газа |
Содержание в 100 нм3, кмоль |
Требуется отдельных элементов для
образования данного количества газа, кг-атом | |||
|
С |
Н |
О |
(N2+Ar),
кмоль | ||
|
Н2 |
2,4196 |
- |
4,8392 |
- |
- |
|
СО |
1,1607 |
1,1607 |
- |
1,1607 |
- |
|
СО2 |
0,1875 |
0,1875 |
- |
0,375 |
- |
|
СН4 |
0,192 |
0,192 |
0,768 |
- |
- |
|
С2Н4 |
0,0134 |
0,0268 |
0,0536 |
- |
- |
|
С2Н2 |
0,3661 |
0,7322 |
0,7322 |
- |
- |
|
СН3 – С=СН |
0,0045 |
0,0135 |
0,018 |
- |
- |
|
НС=С –
С=СН |
0,0045 |
0,018 |
0,009 |
- |
- |
|
С6Н6 |
0,0045 |
0,027 |
0,027 |
- |
- |
|
О2 |
0,0134 |
- |
- |
0,0268 |
- |
|
N2+Ar |
0,0982 |
- |
- |
- |
0,0982 |
|
Сажа
(элементарный углерод) |
0,035 |
0,035 |
- |
- |
- |
|
Итого |
4,4994 |
2,3927 |
6,447 |
1,5625 |
0,0982 |
Из
данных таблицы следует, что на образование всех углерод содержащих
продуктов крекинга требуется 2,3927 кг-атом углерода, или, что то же,
2,3927 кмоль метана. В составе этого количества метана содержится
Таким образом, общий приход кислорода в печь крекинга
составит: Отсюда соотношение СН4:О2 ,
поступающих в печь крекинга, будет СН4:О2=2,6357:1,8052=1:0,6849 Что согласуется с практикой термоокислительного
крекинга. Соотношение технических продуктов
определяется: или СН4(техн):О2(техн)=1:0,677 Таким образом, материальный баланс печи крекинга
можно представить в виде следующей таблицы (на 100 нм3 сухого крекинга):![]() кг-атом водорода, из коих при крекинге израсходовано
6,4470 кг-атом на образование углеводородов, остальные
кг-атом водорода, из коих при крекинге израсходовано
6,4470 кг-атом на образование углеводородов, остальные![]() кг-атом на образование воды. При этом
получено
кг-атом на образование воды. При этом
получено![]() кмоль Н2О, на что потребовалось 1,5625 кг-атом
кислорода.
кмоль Н2О, на что потребовалось 1,5625 кг-атом
кислорода.
![]() кмоль
кмоль
![]()
|
Приход |
Расход | ||||
|
Статья прихода |
Кмоль |
Нм3 |
Статья расхода |
Кмоль |
Нм3 |
|
Метан |
2,3927 |
53,53 |
Водород |
2,4196 |
54,2 |
|
|
|
|
Окись углерода |
1,1607 |
26 |
|
|
|
|
Двуокись углерода |
0,1875 |
4,2 |
|
|
|
|
Метан |
0,192 |
4,3 |
|
Кислород |
1,5622 |
34,94 |
Этилен |
0,0134 |
0,3 |
|
|
|
|
Ацетилен |
0,3661 |
8,2 |
|
|
|
|
Другие углероды (по 0,1%) |
0,0135 |
0,3 |
|
|
|
|
Кислород |
0,0134 |
0,3 |
|
Азот +аргон |
0,0982 |
2,2 |
Азот +аргон |
0,0982 |
2,2 |
|
Итого |
4,0531 |
90,67 |
Итого |
4,4644 |
100 |
|
|
|
|
Водяной
пар |
1,5619 |
33,4 |
|
|
|
|
Сажа |
0,035 |
- |
B.
Тепловой
баланс.
Приход тепла в крекинговую печь составится из:
1. теплового эффекта
реакции крекинга
2. теплового потока
входящего в печь метана и
кислорода
Расход тепла
1) С тепловым потоком газа крекинга
2) Тепловые потери через стенки печи Приход
Подверглось окислительному крекингу
2,3927-0,1920=2,2007 кмоль СН4
вступило при этом в окислительно - восстановительную
реакцию
1,5622-0,0134=1,5488 кмоль О2
На основании этих данных и состава крекинг газа
окисление СН4 можно представить в виде
следующего стехиометрического уравнения:
2,4437СН4+1,7918О2=2,4196Н2+1,1607СО+0,1875СО2+0,0134С2Н4+0,3661С2Н2+0,0045С3Н4+
+0,0045С4Н2+0,0045С6Н6+0,035С+1,5585Н2О+q
1. Тепловой эффект этой реакции определится ( по закону Гесса )
![]()
или![]()
Теплоты образования соответствующих компонентов крекинг – газа и метана определяется так: (в кдж )
|
Н2 |
0 |
0 |
0 |
|
СО |
1,1607 |
109800 |
127445 |
|
СО2 |
0,1875 |
395000 |
74063 |
|
С2Н4 |
0,0134 |
-87510 |
-1173 |
|
С4Н2+С3Н4+С2Н2 |
0,3751 |
-229400 |
-86048 |
|
С6Н6 |
0,0045 |
-54500 |
-245 |
|
Н2О |
1,5619 |
242200 |
378292 |
|
Сгрфит – Саморф |
0,035 |
-14660 |
-513 |
|
Итого |
|
|
491821 |
|
СН4 |
2,2007 |
77870 |
171369 |
|
О2 |
0 |
0 |
0 |
|
Итого |
|
|
171369 |
Следовательно, тепловой эффект реакций, протекающих
при крекинге, составит ( при 20 С )
q=491821 – 171369 =
320452 кдж на 100 нм3 крекинг –
газа.
Крекинг протекает при 1500 С. Тепловой эффект реакций
крекинга при этой температуре определится так: ( в кдж
)
![]()
|
iH2 |
2,4196 |
45220 |
109414 |
|
iCO |
1,1607 |
48624 |
56438 |
|
iCO2 |
0,1875 |
70760 |
13268 |
|
iC2H4 |
0,0134 |
161140 |
2159 |
|
iCnHm+C |
0,4129 |
98044 |
40482 |
|
iH2O |
1,5619 |
61036 |
95332 |
|
Итого |
|
|
317093 |
|
iCH4 |
2,2007 |
103068 |
226822 |
|
iO2 |
1,5488 |
50403,4 |
78065 |
|
Итого |
|
|
304887 |
Количество тепла, выделившегося в реакции крекинга,
составит ( на 100 нм3 газа крекинга
):
q1
= 320452 – ( 317093 – 304887 ) = 308245 кдж
2. Тепловой поток с
метаном и кислородом, входящими в крекинговую печь,
составит:
i
= 2,4437 iCH4
+ 1,7918 iO2
где
iO2
и iCH4
– теплосодержание кислорода и
метана при температуре входа их в
печь.
Для определения этой температуры необходимо подсчитать значение q2 по уравнению
Qприх
= Qрасх или q2
+ 319688 = q3
+ qпотери
Где
q3
– тепловой поток крекинг – газа.
Расход.
Qрасх
= q3
+ qпотери
1. Газы на выходе из зоны крекинга имеют t=1500 С. Тепловой поток их q3 определится так:
|
iH2 |
2,4196 |
45800 |
110818 |
|
iCO |
1,1607 |
49200 |
57106 |
|
iCO2 |
0,1875 |
78600 |
14738 |
|
iCH4 |
0,192 |
103800 |
19930 |
|
iCnHm |
0,393 |
162000 |
63666 |
|
iO2 |
0,0134 |
51000 |
683 |
|
iN2+Ar |
0,0982 |
48600 |
4773 |
|
iH2O |
1,5619 |
61700 |
96369 |
|
iC |
0,3996 |
1500 |
599 |
|
Итого |
|
q3= |
368682 |
2. Теплопотери стенками печи составляют 6 % от прихода, а следовательно, и от общего расхода.
Получаем
Qрасх
= 368682 + 0,06Qрасх
Откуда
Qрасх
= 368682/0,94 = 392215 кдж
3.
Находим
значение q2:
q2 = 392215
– 308245 = 83970 кдж
Это количество
тепла должны нести с собой входящие в печь метан, кислород и примеси к ним
– азот и аргон ( количество их смотри таблицу материального баланса печи
). Примем температуру этих газов
650 С. Тогда тепловой поток их составит ( в кдж ):
|
iCH4 |
2,3927 |
33970 |
|
iО2 |
1,5622 |
20700 |
|
iN2+Ar |
0,0982 |
19750 |
|
Итого |
q2'= |
74420 |
Получено q2’ > q2. Примем t = 800 С. Тогда будем иметь ( в кдж )
|
iCH4 |
2,3927 |
44800 |
|
iО2 |
1,5622 |
25860 |
|
iN2+Ar |
0,0982 |
24820 |
|
Итого |
q2''= |
95480 |
Получено q2’’ < q2. Отсюда интерполяцией находим температуру метана и кислорода, до которой они должны быть нагреты перед входом в крекинговую печь:
![]()
Расход воды на охлаждение газа в крекинг – печи.
Предварительное охлаждение крекинг – газа производится ( на выходе его из
контактной зоны ) путем обрызгивания через сопла холодной водой. При этом
газ охлаждается до 700 – 800 С, и тепловой поток его составит примерно
160000 кдж. Принимая температуру воды при входе в печь 15 С, а на выходе
75 С, получим расход воды на охлаждение ( из расчета на 100 нм3 сухого газа )![]()