



Примеры составления материальных балансов необратимых химико-технологических процессов
Пример 1.
Составить материальный баланс хлоратора в производстве хлорбензола (на 1 т хлорбензола). Содержание жидких продуктов [% (масс.)]: бензола - 65,0; хлорбензола - 32,0; дихлорбензола - 2,5; трихлорбензола - 0,5. Технический бензол содержит 97,5% (масс.)C6H6, технический хлор - 98% (масс.) Cl2.
Молекулярная масса:
C6H6 - 78; C6H5Cl -112,5; C6H4Cl2 - 147; C6H3Cl3 - 181,5; Cl2 - 71; HCl - 36,5.Подход 1 к решению примера 1:
Решение. Хлорбензол является полупродуктом для получения различных производных бензола, таких, как фенол, анилин и др. Получают его, пропуская хлор в жидкий бензол, в присутствии хлорида железа (III). По мере образования хлорбензола по основной реакции
C6H6 + Cl2 ® C6H5Cl + HCl (1)
происходит дальнейшее хлорирование
C6H5Cl + Cl2 ® C6H4Cl2 +HCl
или C6H6 + 2Cl2 ® C6H4Cl2 + 2HCl (2)C6H4Cl2 + Cl2 ® C6H3Cl3 или C6H6 + 3Cl2 ® C6H3Cl3 + 3HCl (3)
Чтобы предотвратить образование больших количеств полихлоридов хлорирование следует прекращать при содержании в реакционной смеси несколько больше половины введённого бензола (60 - 65%).
В продукционной (жидкой) смеси находится, согласно заданному составу жидких продуктов реакции, 1000 кг
C6H5Cl; 1000*2,5/32 = 78 кг C6H4Cl2; 1000*0,5/32 = 15,6 кг C6H3Cl3 , а, кроме того, 372,4 кг HCl, полученного:по реакции (1) 1000*36,5/112,5 = 324 кг
по реакции (2) 78*2*36,5/147 = 39 кг
по реакции (3) 15,6*3*36,5/181,5 = 9,4 кг
Расход (кг) чистого бензола (на 1 т продукта):
на образование
C6H5Cl 1000*78/112,5 = 693на образование
C6H4Cl2 78*78/147 = 41на образование
C6H3Cl3 15,6*78/181,5 = 6,7непрореагировавшего 1000*65/32 = 2031,0
общий 2771,7
технического 2771,7/0,975 = 2842,8
Расход (кг) хлора:
на образование
C6H5Cl 1000*71/112,5 = 631на образование
C6H4Cl2 78*2*71/147 = 75на образование
C6H3Cl3 15,6*3*71/181,5 = 18,3общий 724,3
технического 724,3/0,98 =
739Материальный баланс хлоратора бензола (на 1 т хлорбензола):
Приход кг Расход кг
Технический бензол
C6H5Cl 1000C6H6 2771,7 C6H4Cl2 78
примеси
71,1 C6H3Cl3 15,6Технический хлор
C6H6 2031Cl2 724,3 HCl 372,4
примеси 14,7 примеси к C6H6 71,1
примеси к
Cl2 14,7Итого
: 3581,8 Итого: 3582,8
Подход 2 к решению примера 1:
Рассчитать материальный баланс хлоратора в производстве хлорбензола (1тонна), если состав жидких продуктов следующий:
W(![]() )= 0,65
)= 0,65
W(![]() )= 0,32
)= 0,32
W(![]() )= 0,025
)= 0,025
W(![]() )= 0,005
)= 0,005
W1(![]()
W2(![]()
Происходят следующие реакции хлорирования:
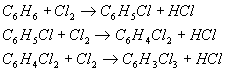
Решение:
1.
Находим молекулярные массы всех имеющихся веществ.М(
М(
М(
М(
М(
М(
2.
Находим массу смеси и её компонентов из следующих соображений.Если содержание в смеси
W(С6Н5Сl)= 0,32 а его, массаW
(всей смеси)= 1, тогда масса смеси = m(всей смеси) кг![]()
Массы остальных компонентов аналогично:
![]()
![]()
![]()
3.
Подставляем полученные данные в уравнения реакции: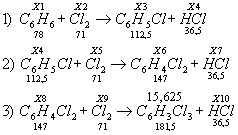
Мы не можем вместо
X1, подставить массу бензола, полученную в пункте 2., т.к.неизвестно сколько его пошло в реакцию.
Мы не можем вместо
X3 и X6, подставить массы хлоридов, полученных в пункте 2., т.к.X3 = 1000 +X
4 - часть из Х3 пошло на следующую реакцию,X6 = 78,125 +X
8 - часть из Х6 пошло на следующую реакцию.Но мы точно знаем, что
Будем считать от него, постепенно передвигаясь к первому уравнению.
Масса
Тогда
X6 = 78,125 + X8 =78,125 + 12,655 = 90.78 кгМасса
Тогда
X3 = 1000 +X4 = 1000 + 69,5 = 1069,5 кг4.
Рассчитаем массы остальных веществ в реакциях.![]()
![]()
![]()
Всего
m(![]()
![]()
![]()
Всего
m(Масса технического хлора пошедшего на реакцию
![]()
Масса прореагировавшего бензола
![]()
Всего масса бензола в т.ч. непрореагировшего бензола:
![]()
Масса технического бензола всего
![]()
Ответ:
масса технического бензола
масса технического хлора
масса выделевшегося хлороводорода
m(
Подход 3 к решению примера 1:
Дано:
Рассчитать материальный баланс хлората в производстве хлорбензола (1тонна), если состав жидких продуктов следующий:
W(![]() )= 0,65
)= 0,65
W(![]() )= 0,32
)= 0,32
W(![]() )= 0,025
)= 0,025
W(![]() )= 0,005
)= 0,005
W1(![]()
W2(![]()
Происходят следующие реакции хлорирования:
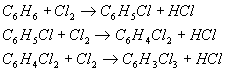
Решение:
1.
Находим молекулярные массы всех имеющихся веществ.М(
М(
М(
М(
М(
М(
2.
Находим массу смеси и её компонентов.Если содержание в смеси
W(С6Н5Сl)= 0,32,а его массаРешим пропорцию и определим массу смеси
0,32¾ ¾ ¾ ¾
1000 кг1 ¾ ¾ ¾ ¾ m
(всей смеси)![]()
Массы остальных компонентов аналогично:
![]()
![]()
![]()
3.
Подставляем полученные данные в уравнения реакции: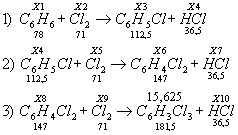
Взаимодействие хлора и бензола может протекать, если хлор взят в избытке, а бензол в недостатке вступил в реакцию. Это означает, что количество молей хлора больше, чем кол-ва молей бензола. Количество молей вещества - это отношение массы вещества к его молярной массе.
n=m/MОпределение масс веществ участвующих в материальном балансе начнём находить с уравнения №3. Это последняя стадия превращения, следовательно, в ней вещества находятся в равновесии, и их кол-ва молей равны.
4.
Нахождение масс веществ, вступивших в реакцию №3.Нам известна масса продукта реакции
![]()
n(![]() )=n(
)=n(![]() )=n(
)=n(![]() )=n(
)=n(![]() )=0,086
)=0,086
m(![]() )=n(
)=n(![]() )*M(
)*M(![]() )=0,086*36,5=3,1
)=0,086*36,5=3,1
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
5.
Определение масс веществ, вступивших в реакцию №2.Из данных задачи нам известно, что
m(Это та, часть
Но нам для определения кол-ва молей
В итоге получим
m(![]()
n(![]() )=n(
)=n(![]()
n(![]() )=n(
)=n(![]()
т.к.
В этой реакции хлор находитися в избытке по-этому для определения его кол-ва молей
необходимо сложить кол-во молей
n(![]() )=n(
)=n(![]() )+n(
)+n(![]()
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
6.
Нахождение масс веществ, вступивших в реакцию №1.Из данных задачи нам известно, что в смеси
m(Это та, часть
Но нам для определения кол-ва молей
В итоге получим
m(Найдём кол-ва вещества
n(![]() )=m(
)=m(![]() )/M(
)/M(![]()
В этой реакции бензол в недостатке, значит,
n(![]() )=n(
)=n(![]() )=n(
)=n(![]()
Кол-во молей хлора равно сумме кол-во молей бензола, пошедшего на образование
n(![]() )=n(
)=n(![]() )+n(
)+n(![]()
Определяем массы веществ:
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
m(![]() )=n(
)=n(![]() )*M(
)*M(![]() )=10,202*71
)=10,202*71
m(![]() )=n(
)=n(![]() )*M(
)*M(![]()
7.
Запишем общие массы веществm(![]()
m(![]() )=m1(
)=m1(![]() )+m2(
)+m2(![]() )+m3(
)+m3(![]()
Масса прореагировавшего бензола
m(![]()
m(![]()
m(![]()
m(![]()
Масса технического хлора пошедшего на реакцию
![]()
Всего масса бензола в т.ч. непрореагировшего бензола:
![]()
Масса технического бензола всего
![]()
Ответ:
масса технического бензола
масса технического хлора
масса выделившегося хлороводорода
m(
Пример 2.
Составить материальный баланс печи для сжигания серы производительностью 60 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха
= 1,5. Расчёт вести на производительность печи по сжигаемой сере в кг/ч.Решение.
Процесс сгорания серы описывается уравнением:
S + O2 = SO2.Производительность печи 60*10
3/24 = 2500 кг/ч.Масса серы:
Окисленной до
SO2 2500*0,95 =2375 кгНеокисленной 2500 - 2375 = 125 кг
Израсходовано кислорода:
на окисление 2375*22,4/32 = 1663 м
3с учётом
м3 2495*32/22,4 = 3560 кгПоступило с кислородом азота:
2495*79/21 = 9380 м
3 или 9380*28/22,4 = 11700 кгОбразовалось
SO2 по реакции:2375*64/32 = 4750 кг или 4750*22,4/64 = 1663 м
3Осталось неизрасходованного кислорода:
1663
*0,5 = 831 м3 или 831*32/22,4 = 1185 кгМатериальный баланс печи (1 ч):
Приход кг м
3 Расход кг м3S 2 500 S 125
O2 3 560 2 495 SO2 4 750 1 663
N2 11 700 9 380 O2 1 185 831
N2 11 700 9 380
Итого: 17 760 11 875 Итого: 17 760 11758
Пример 3.
Составить материальный баланс производства оксида этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси [% (об.)]: этилен - 3, воздух - 97. Степень окисления этилена 0,5. Расчёт вести на 1 т оксида этилена.
Решение. Оксид этилена - это один из важнейших полупродуктов различных синтезов: получения этиленгликоля, полигликолей, лаковых растворителей, пластификаторов, этаноламинов, эмульгирующих и моющих средств; соединения, синтезируемые из оксида этилена, находят применение в производстве синтетических волокон, каучуков и других продуктов. Применяют два метода получения оксида этилена:
- Гипохлорирование этилена с последующим отщепления хлороводорода от получающегося этиленхлоргидрина.
- Прямое каталитическое окисления этилена. При пропускании смеси воздуха с этиленом (нижний предел взрываемости этиленовоздушной смеси - 3,4%
2CH2 = CH2 + O2 = 2(CH2)2O
который выделяют из газовой смеси водной абсорбцией; остаточный газ направляют во 2-й контактный аппарат.
Расход этилена на 1 т оксида этилена по реакции
28*1000/44 = 640 кг
с учётом степени окисления:
640/0,5 = 1280 кг или 1280*22,4/28 = 1020 м
3Объём воздуха в этиленовоздушной смеси
1020*97/3 = 33000 м3
в том числе кислорода
33000*0,21 = 6800 м3 или 6800*32/22,4 = 9700 кг
азота
33000*0,79 = 26200 м
3 или 26200*28/22,4 = 32500 кгИзрасходовано кислорода на окисление:
1020*0,5/2 = 255 м3
Содержание кислорода в продуктах окисления:
6800 - 255 = 6545 м
3 или 6545*32/22,4 = 9340 кгМатериальный баланс на 1 т оксида этилена:
Приход кг м
3 Расход кг м3Этилен 1 280 1 020 Оксид этилена 1000 510
Кислород
9 700 6 800 Этилен 640 510Азот
32 500 26 200 Кислород 9 340 6 545Азот 32 500 26 200
Итого: 43 480 34 020 Итого: 43 480 33 76
5
Пример 4.
Составить материальный баланс производства фтороводорода (на 1 т HF) из плавикового шпата, содержащего [% (масс.)]: CaF2 - 96; SiO2 - 4. Степень разложения шпата 0,95. Для разложения применяют 93%-ную H2SO4 с 15%-ным избытком от теоретического.
Молекулярная масса: CaF2 -78; H2SO4 - 98; CaSO4 -136; HF - 20; SiO2 -60; H2SiF6 - 144.
Решение:
Разложение идёт по реакциям:
CaF2 + H2SO4 = CaSO4 + 2HF (1) SiO2 + 6HF = H2SiF6 + 2H2O (2)
Фтороводород растворяется в воде с образованием плавиковой кислоты, которая используется как в производстве фторидов, так и для органического синтеза, травления стекла и т. д.
По условию в 100 кг шпата содержится 96 кг
CaF2 и 4 кг SiO2. При разложении 100 кг породыПо реакции (1) образуется 96*20*2/78 = 49 кг
HFПо реакции (2) образуется 6*20*4/60 = 8 кг
HFВ результате реакций (1) и (2) из 100 кг породы получается 49 - 8 =41 кг
HF, т.е. для обеспечения выхода 1 т HF требуется100*1000/41 = 2440 кг породы, из них 2340 кг
CaF2 и 100 кг SiO2.с учётом степени разложения:
2440/0,95 =2570 кг породы, из них 2467 кг
CaF2 и 103 SiO2Расход (кг) серной кислоты (моногидрата):
по реакции 98*2340/78 = 2950
с учётом её избытка 2950*1,15 =3400
93%-ной 3400/0,93 = 3640
Расход вводимой с
H2SO4 воды: 3640 - 3400 = 240 кг.Состав (кг) продукционной смеси:
CaSO4 2340*136|78 = 4050
H2SiF6 144*100|60 = 240
H2O
(по реакции) 36*100/60 = 60
Материальны баланс реактора (на 1 т
HF):Приход кг Расход кг
CaF2 2467 HF 1000
SiO2 103 CaSO4 4050
H2SO4 (
моногидрат) 3400 H2SiF6 240H2O 240 H2O
(по реакции) 60H2O
(вводимая с H2SO4 ) 240H2SO4 450
CaF2 127
SiO2 3
Итого: 6210
Итого: 6170
Пример 5
.Составить материальный баланс реактора для каталитического окисления метанола в формальдегид. Производительность реактора 10000 т
CH2O в год. Степень превращения CH3OH в CH2O 0,7. Общая степень превращения метанола 0,8(с учётом побочных реакций). Содержание метанола в спирто-воздушной смеси 40% (об.). Мольное соотношение побочных продуктов в продукционном газе HCOOH: CO2: CO: CH4 = 1,8: 1,6:0,1:0,3. Агрегат работает 341 день в году (с учётом планово-предупредительного ремонта и простоев). Окисление происходит на твёрдом серебряном катализаторе при 600 Co .Расчёт вести на производительность реактора в кг/ч. молекулярная масса: формальдегида - 30; метанола - 32; кислорода - 16
.Решение. Чрезвычайная реакционная способность формальдегида обусловливает его широкое применение в качестве полупродукта в органических синтезах, особенно в производстве синтетических смол и других веществ. Формальдегид получают главным образом окислением метанола воздухом при 550 - 600
Co на серебряном катализаторе; одновременно протекает реакция дегидрирования метанола:CH3OH + 1/2 O2 = CH2O + H2O (1); CH3OH = CH2O + H2 (2)
Обычно на реакцию подают лишь около 80% воздуха от количества, соответствующего мольному отношению
CH3OH: O2 = 2:1 и проводят процесс с неполным сгоранием образовавшегося водорода по реакцииH2 + 1/2O2 = H2O (3)
Выходящие из контактного аппарата газы содержат 20 -21% формальдегида, 36 -38% азота и примеси в виде
CO, CO2 , CH4, H2, CH3OH, HCOOH и др. Образование примесей можно представить уравнениями:CH3OH = CO + 2H2 (4); CH3OH + H2 = CH4 + H2O (5)
CH3OH + O2 = HCOOH + H2O (6); CH3OH + 1,5O2 = CO2 + 2H2O (7)
Вся эта смесь после охлаждения в холодильнике до 60
Co поступает в поглотительную башню, орошаемую водой. Полученный в результате поглощения раствор формалина содержит 10 - 12% метанола, который в данном случае является желательной примесью, так как препятствует полимеризации формальдегида.Производительность реактора:
10000*1000/(341*24) = 1220 кг/ч или 1220/30 40,7 кмоль/ч CH2O
Для получения такого количества формальдегида необходимо метанола [по реакциям (1) и (2) на 1 моль формальдегида расходуется 1 моль метанола]:
1220*32/(30*0,7) = 1860 кг или 1860/32 = 58,12 кмоль
Определим объёмы:
метанола 1860*22,4/32 =1300 м
3спирто-воздушной смеси 1300/0,4 = 3250 м
3воздуха 3250 -1300 = 1950 м
3 , из них 1950*0,21 = 410 м3 или 586 кг O2 и 1930*0,79 = 1540 м3 или 1920 кг N2В составе газовой продукционной смеси содержатся
CH2O, неокисленный CH3OH, азот и побочные продукты: HCOOH, CO2, CO, CH4, H2, а также водяной пар. Определим, какое количество метанола расходуется на образование побочны продуктов. На образование 1 моля побочных продуктов по реакциям (4) - (7) расходуется 1 моль CH3OH. Всего на образование побочных продуктов израсходовано58,12*0,8 - 40,7 = 5,8 кмоль CH3OH
Осталось неокисленным в составе продукционных газов:
58,12*0,2 = 11,6 кмоль или 372 кг CH3OH
Образовалось в соответствии с заданным мольным соотношением
HCOOH: CO2: CO: CH4 = 1,8: 1,6: 0,1: 0,3 (
всего 3,8):кмоль кг
HCOOH 5,8*1,8/3*8 = 2,75 126,5
CO2 5,8*1,6/3*8 = 2,45 108
CO 5,8*0,1/3*8 = 0,158 4,3
CH4 5,8*0,3/3*8 = 0,459 7,3
Для определения количества водяного пара и водорода в газах синтеза составляем баланс по кислороду и водороду.
В реактор поступило кислорода (кг):
с воздухом 586
в составе CH3OH 1860*16/32 = 930
Всего 1516 кг. Израсходовано кислорода (кг):
на образование
CH2O 1220*16/30 = 650>> >> HCOOH 126,5*32/46 = 88
>> >> CO2 108*32/44 = 78,6
>> >> CO 4,3*16/28 = 2,45
в составе неокисленного метанола 372*16/32 = 186
Всего 1005 кг. Остальное количество кислорода, равное 1516 - 1005 = 509 кг, пошло на образование воды по реакциям (1), (3), (5)-(7). В результате получено 509*18/16 = 572 кг
H2O.В реактор поступило водорода:
186
0*4/30 = 233 кгИзрасходовано водорода (кг):
на образование
CH2O 1220*2/30 = 81,5>> >> HCOOH 126,5*2/46 = 5,5
>> >> CH4 7,3*4/16 = 1,82
>> >> H2O 572*2/18 = 63,6
в составе неокисленного
CH3OH 372*4/32 = 46,5Всего 198,92 кг. Остальное количество водорода входит в состав контактных газов в свободном состоянии: 233 - 198,92 = 34,08 кг.
Материальный баланс реактора (1 ч работы):
Приход кг Расход кг
Спирто-воздушная смесь Формальдегид
1220CH3OH
1860 Метанол 372кислород 586 Водяной пар 572
азот
1920 HCOOH 126,5CO2 108
CO 4,3
CH4 7,3
H2 34,08
N2 1920
Итого: 4366 Итого: 4364,18
Пример 6.
Составить материальный баланс получения полиэтилентерефталата (ПЭТФ), идущего на изготовление 1 т синтетического волокна. В готовом волокне содержится, %(масс.): влаги - 0,5; замасливателя - 0,5; диоксида титана - 0,5. Потери при изготовлении волокна составляют 4,85%.
Сырьём для производства ПЭТФ являются терефталевая кислота (ТФК)
HOOC COOH и этиленгликоль HO - CH2 - CH2 - OH.
Молекулярная масса: ТФК = 166; элементарного звена полимера
O O
[ C C - O - C2H4 - O -]n -192; этиленгликоля - 62.
Решение: Для изготовления 1 т волокна потребуется:
ПЭТФ 1,000 - (0,005+0,005+0,005) = 0,985 т
с учётом потерь 0,985*1,0485 = 1,033 т
Расход 100%-ной ТФК:
1,033*166/192 = 0,893 т
На 1 моль ТФК берётся (по опытным данным) 1,5 моля этиленгликоля, т. е. На 1 т ТФК потребуется:
1,5*62/166 = 0,56 т этиленгликоля (100%-ного)
Затрачивается этиленгликоля:
на процесс поликонденсации 0,56*0,893 = 0,5 т
на регенерацию 0,5*0,5/1,5 = 0,167 т
нерегенерированного 0,5 = 0,167 = 0,333 т
Избыточные 0,5 моля этиленгликоля, направленные на регенерацию, возвращаются в процесс.
При образовании элементарного звена ПЭТФ выделяется 2 моля
H2 O, следовательно, на 1,033 т ПЭТФ образуется:2*18/192 = 0,188 т
H2 OМатериальный баланс получения ПЭТФ:
Приход кг Расход кг
ТФК 0,893 ПЭТФ
1,033Этиленгликоль Этиленгликоль
свежий 0,333 на регенерацию 0,167
регенерированный 0,167 вода
0,188Итого: 1,393 Итого: 1,387
Расхождение баланса:
[(1,393 - 1,387)/1,393]*100 = 0,4%.
|
|
|
|